viernes, 10 de diciembre de 2010
sábado, 27 de noviembre de 2010
martes, 12 de octubre de 2010
domingo, 26 de septiembre de 2010
Totalitarismos
Check out this SlideShare Presentation:
Totalitarismos
View more presentations from campos21.
jueves, 16 de septiembre de 2010
lunes, 13 de septiembre de 2010
AUTOTEST
DIVISIBILIDAD
MÚLTIPLOS
DIVISORES
PRIMOS
CRITERIOS
Dos números están emparentados por la relación de divisibilidad cuando uno cabe en el otro un número exacto de veces, es decir, cuando su cociente es exacto.
MÚLTIPLOS
DIVISORES
PRIMOS
CRITERIOS
Dos números están emparentados por la relación de divisibilidad cuando uno cabe en el otro un número exacto de veces, es decir, cuando su cociente es exacto.
Si la división 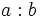 es exacta diremos que:
es exacta diremos que:
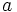 es multiplo de
es multiplo de 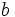 ó
ó 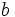 es divisor de
es divisor de 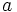 , si existe un número natural
, si existe un número natural 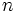 tal que
tal que 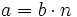 .
.
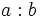 es exacta diremos que:
es exacta diremos que: 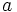 es un múltiplo de
es un múltiplo de 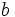 , y lo expresaremos simbólicamente:
, y lo expresaremos simbólicamente: 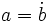
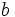 es un divisor de
es un divisor de 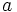 , y lo expresaremos simbólicamente:
, y lo expresaremos simbólicamente: 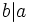 .
.
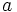 es multiplo de
es multiplo de 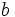 ó
ó 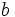 es divisor de
es divisor de 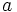 , si existe un número natural
, si existe un número natural 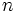 tal que
tal que 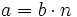 .
. | Divisible por: | Criterio | ||
|---|---|---|---|
| 2 | El número acaba en 0 ó cifra par. | ||
| 3 | La suma de sus cifras es un múltiplo de 3. | ||
| 4 | El número formado por las dos últimas cifras es múltiplo de 4. | ||
| 5 | La última cifra es 0 ó 5. | ||
| 6 | El número es divisible por 2 y por 3. | ||
| 8 | El número formado por las tres últimas cifras es múltiplo de 8. | ||
| 9 | La suma de sus cifras es múltiplo de 9. | ||
| 10 | La última cifra es 0. | ||
| 11 | Se suman las cifras que forman el número de forma alternativa y se restan los resultados para ver si da un múltiplo de 11 (El cero también lo es) |
lunes, 6 de septiembre de 2010
miércoles, 25 de agosto de 2010
domingo, 22 de agosto de 2010
ESOS TERRIBLES Y FASCINANTES VOLCANES
Un volcán constituye el único conducto que comunica la superficie terrestre con los niveles profundos de la corteza terrestre. A lo largo de la historia algunos volcanes, han tenido efectos devastadores para el hombre y el medio ambiente.
La naturaleza de una erupción volcánica depende de muchos factores, incluido el tipo de magma en profundidad, su temperatura, la cantidad de gases que lleva disueltos a presión, el espesor de la capa de roca y su resistencia a la fractura.
La causa de una erupción es el alivio de presión por encima de la cámara magmática. Este alivio produce la separación de la fase gaseosa, la que se expande e impulsa la lava y los fragmentos de roca. Uno de los tipos de lava espumosa, cuando se solidifica se denomina “pumita” o “pumicita”. Algunas lavas son tan viscosas que las burbujas, al expandirse, las hacen estallar en partículas muy calientes, llamadas “cenizas”, las que pueden formar las denominadas nubes ardientes o flujos piroclásticos que se desploman por las laderas de los volcanes a gran velocidad.
Como se observa la lava líquida no es el único producto de la erupción, los gases cumplen un papel fundamental en la propulsión de la lava líquida y los fragmentos de roca expulsados.
SIMULAR VOLCANES...
SIMULAR ERUPCIONES.
UN EXPERIMENTO
Reacciones químicas: reacción con desprendimiento de gases
Material que vas a necesitar:
- Bicarbonato del que se vende en las farmacias
- Vinagre
- Limón
En la experiencia vamos a ver cómo reacciona el bicarbonato de sodio (NaHCO3) con sustancias que tienen un carácter ácido. Podrás ver cómo se descompone el bicarbonato y se desprende un gas, el dióxido de carbono. Esto ocurre porque el vinagre y el zumo de limón son sustancias que llevan disueltos ácidos: ácido acético, en el caso del vinagre, y ácido cítrico, en el caso del limón.
La reacción química que tiene lugar es la siguiente:
Los productos que se obtienen son: una sal (NaAc) que queda disuelta en el agua (H2O) y dióxido de carbono (CO2) que al ser un gas burbujea a través del líquido.NaHCO3 + HAc ----> NaAc + CO2 + H2O
¿Qué debes hacer?
Experimento 1
Experimento 2
- En el fondo de un vaso, o en un plato, coloca un poco de bicarbonato de sodio en polvo.
- Deja caer sobre él unas gotas de vinagre. ¿Qué ocurre? Observa el efecto del gas que se desprende.
- Repite la experiencia utilizando jugo de limón en vez de vinagre.
- Haz otros experimentos para ver si el bicarbonato reacciona con otras bebidas ácidas (por ejemplo, jugo de naranja, jugo de manzana, refresco de cola, etc.).
- Prepara una disolución con 1 cucharadita de bicarbonato en medio vaso de agua.
- Utiliza una parte de la disolución para ver cómo reacciona con el vinagre y otra para el jugo de limón.
- Repite la experiencia con disoluciones más concentradas de bicarbonato (2, 3 cucharaditas, etc.) y compara los resultados obtenidos con los del caso anterior. ¿Observas diferencias? ¿Cuáles?
Sigue experimentando
Ahora podemos intentar recoger el gas (dióxido de carbono) que hemos obtenido. Para ello vamos a repetir el experimento 2 utilizando una botella, en vez de un vaso, y un globo.
Puedes probar con distintas cantidades de reactivos (vinagre y bicarbonato) y ver cómo varía la presión del gas en el globo.
- Pon vinagre en una botella.
- En un globo pon una cucharadita de bicarbonato.
- Sujeta el globo en la boca de la botella, con cuidado para que no caiga el bicarbonato. Ya tenemos preparado el experimento.
- Levanta el globo y deja caer el bicarbonato sobre el vinagre. Observa como según se va desprendiendo el dióxido de carbono el globo se va hinchando.
VER VIDEO1
Suscribirse a:
Entradas (Atom)

















